
Ecco un articolo di sperimentazione che darà l'occasione di realizzare, con una spesa irrisoria, delle pile alla frutta. Si tratta di divertenti e didattiche realizzazioni che, molto spesso, studiano i bambini alla scuola elementare e hanno lo scopo di sensibilizzare gli alunni allo studio della fisica, chimica ed elettricità. Anche gli sperimentatori possono provare realizzare tali pile, un po' per gioco e un po' per curiosità. Quali sono i risultati che si possono ottenere e qual è il rendimento di questi generatori? Conviene, o no, realizzarli? E con quale spesa? Quali dispositivi possono azionare tali generatori? Essi danneggiano l'ambiente? Lo scopriremo leggendo le informazioni che seguono.
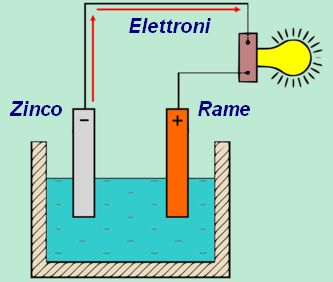
La pila è un dispositivo che trasforma l'energia chimica in energia elettrica. E' costituita da due conduttori metallici immersi in una soluzione. I conduttori sono di prima classe, in quanto trasportano elettricità attraverso gli elettroni. La soluzione è, invece, di seconda classe perché la corrente viaggia per mezzo del movimento di ioni. L'insieme di questi elementi costituisce la cella galvanica (o pila) capace di generare una differenza di potenziale. Quest'ultima determina una forza elettromotrice (f.e.m.) che spinge gli elettroni verso una direzione. Il processo chimico di produzione di corrente avviene per un processo di ossidazione e un altro di riduzione. Il risultato che ne consegue è un potenziale elettrico, il cui valore dipende dalle reazioni chimiche che si verificano.
Quando i due poli della pila si collegano tra loro mediante un conduttore o un semiconduttore, avviene il passaggio di elettroni che, inevitabilmente, si attenua quando le reazioni chimiche decadono e l'intero sistema si pone in equilibrio (pila scarica).
Elettrochimica
Il fenomeno della trasformazione da energia chimica in energia elettrica è osservato dalla Elettrochimica che studia, appunto, tutti quei processi che coinvolgono il trasferimento di elettroni per mezzo dell'ossidazione e della riduzione (denominate reazioni Redox).
Quando si chiude il circuito, si stabilisce un passaggio di elettroni dovuto alla differenza di potenziale elettrochimica tra i due elettrodi. In altre parole, ogni elettrodo è caratterizzato da un potenziale di riduzione (messo a confronto con quello dell'idrogeno, che vale zero). Tale parametro è contrassegnato con il simbolo di E°. La differenza aritmetica tra i due potenziali fornisce la tensione che si stabilisce ai capi della pila.
E' possibile creare il sistema al contrario, ossia fornendo energia elettrica agli elettrodi che si trasforma in energia chimica di legame. Tale possibilità è utilizzata nei processi a elettrolisi.
I vari elementi sono caratterizzati, come detto, da un potenziale elettrochimico; alcuni sono di segno positivo, altri di segno negativo. Il comportamento chimico è, quindi, il seguente:
- Per gli elementi con potenziale positivo avviene una reazione di riduzione (e rimangono quasi intatti);
- Per gli elementi con potenziale negativo avviene una reazione di ossidazione (un po' si corrodono).
Pertanto la tensione elettrica di una pila (comprese quelle alla frutta) non sarà determinata dalla tipologia e dalla qualità dell'elettrolita (succo di limone o altro) bensì dalla differenza tra i due potenziali elettrochimici degli elettrodi (semi-celle), oltre che dalla sovratensione e dalla caduta ohmica.
Esiste una speciale tabella (che non ha la pretesa di essere completa) che elenca tali potenziali. Ci si riferisca a essa quando si vuol realizzare un generatore elettrochimico.
| Nome | Elemento | E° |
| Litio | Li | -3,045 |
| Potassio | K | -2,925 |
| Bario | Ba | -2,9 |
| Calcio | Ca | -2,87 |
| Sodio | Na | -2,714 |
| Magnesio | Mg | -2,37 |
| Berillio | Be | -1,85 |
| Alluminio | Al | -1,66 |
| Titanio | Ti | -1,63 |
| Manganese | Mn | -1,18 |
| Vanadio | V | -1,18 |
| Zinco | Zn | -0,763 |
| Cromo | Cr | -0,74 |
| Ferro | Fe | -0,44 |
| Cadmio | Cd | -0,403 |
| Cobalto | Co | -0,277 |
| Nickel | Ni | -0,25 |
| Stagno | Sn | -0,136 |
| Piombo | Pb | -0,126 |
| Idrogeno | H2 | 0 |
| Rame | Cu | 0,35 |
| Argento | Ag | 0,799 |
| Rodio | Rh | 0,80 |
| Palladio | Pd | 0,987 |
| Oro | Au | 1,68 |
Perché rame e zinco?
Nelle documentazioni ufficiali, riguardo alla realizzazione delle pile si utilizzano, quali elettrodi, sempre il Rame e lo Zinco. Si tratta di elementi chimici molto [...]
ATTENZIONE: quello che hai appena letto è solo un estratto, l'Articolo Tecnico completo è composto da ben 2375 parole ed è riservato agli ABBONATI. Con l'Abbonamento avrai anche accesso a tutti gli altri Articoli Tecnici che potrai leggere in formato PDF per un anno. ABBONATI ORA, è semplice e sicuro.








Grazie per il tuo articolo, veramente simpatico e scientifico. Dimostra che bisognerebbe sempre partire dal molto semplice per comprendere realmente i fenomeni fisici, chimici, etc.
Grazie per l’articolo; mi ha fatto tornare in mente quei bei giorni a scuola, ricordi che ormai vanno a svanire. Spesso preso nel progettare circuiti “complessi” dimentico quanto possa essere divertente realizzare un progetto simpatico come questo. Se riesco a recuperare le barrette di zinco, domenica, proverò a realizzare la batteria con i miei tre pargoli 😉
Articolo molto bello.
A me ha fatto tornare in mente un seminario Microchip al quale ho partecipato e dove presentavano i nuovi (all’epoca) micro in tecnologia nanoWatt. Come esempio finale presentarono un progetto con un pic nanowatt appunto ed un piccolo LCD che visualizzava la temperatura ambiente alimentadosi solamente da un paio di arance.
Mi ricordo i FAE dell’Arrow (all’epoca distributore Microchip) che giravano con la busta di arance 🙂
Grazie ai lettori.
Certe volte penso che sulla Terra i popoli fanno a botte per l’energia.
E pensare che l’universo è pieno di energia nucleare, basti solo considerare la nostra galassia. Miliardi di esplosioni nucleari, bagliori ed altro che potrebbero alimentare la Terra per miliardi di anni, gratuitamente, se solo riuscissimo a catturare tale fonte energetica.
L’energy harvesting è proprio la dimostrazione che siamo circondati di energia, energia gratis, che aspetta solo di essere catturata.
L’energia dovrebbe essere gratuita, proprio come l’acqua e l’aria. Prossimamente pubblicheremo un articolo proprio su questo.
Mi hai fatto riconsiderare l’espressione “stare alla frutta”. Non è poi così negativa in quanto si ha ancora energia disponibile :—-)
L’unico problema dell’energia dalla frutta come da tantissime altre fonti naturali da cui si potrebbe produrla o ricavarla, e’ che non si puo’ mettere un contatore per farla pagare.
Questo e’ sempre stato e presumo che sara’ per sempre il vero problema delle fonti alternative.